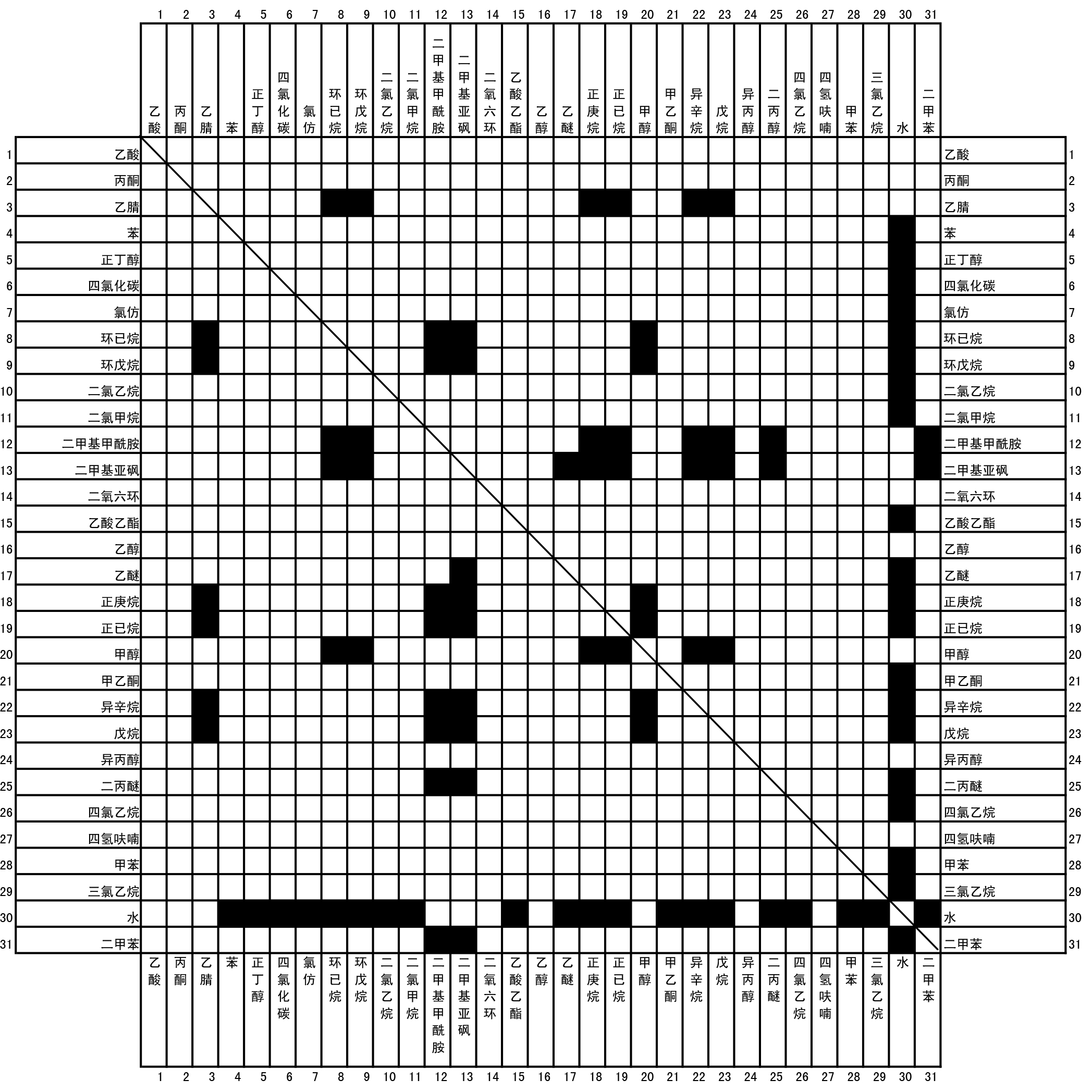
超净台操作原则
进入台内
- 紫外灯消毒30min,关闭后开照明与2档通风
- 拿一个废液杯
- 物体喷酒精消毒
- 手喷酒精消毒
- 酒精棉擦拭仪器,从内到外擦拭台面
- 点亮酒精灯
离开台面
- 熄灭酒精灯
- 移液枪调回最大量程
- 酒精棉擦拭仪器,从内到外擦拭台面
菌种培养
- 取15mL样品管
- 加入2mL LB培养液
- 从超低温低冰箱取出转移器,取大肠杆菌样品管放入其中,转移至操作台
- 移液枪戳取少量杆菌,在样品管抽打
- 用封口胶封口,样品管做好标记,菌名,日期,作者
- 将转移器连同大肠杆菌放回冰箱
- 将样品放入培养箱,倾斜45度插入恒温摇床
菌液稀释操作
实验目的
培养的大肠杆菌浓度一般大大超过测试标准值,故需要稀释。
实验原理
通过PDS润洗,离心3次达到去除培养基目的。再分别稀释5,10,20倍后通过酶标仪测试OD值,从而计算原液中大肠杆菌的浓度。最后按相应倍数稀释得到标准浓度菌液。
实验操作
材料准备
大肠杆菌液样品管、样品管饭盒、移液枪枪头盒、孔板架、15mL样品管。
清除培养基
- 将1mL大肠杆菌从样品管吸出加入离心管,离心120s沉淀,吸出培养基溶液
- 加入1mLPBS溶液,用移液枪抽打,震摇,离心120s重复3次
- 最后加入1mL PBS配置成母液
注意震摇操作
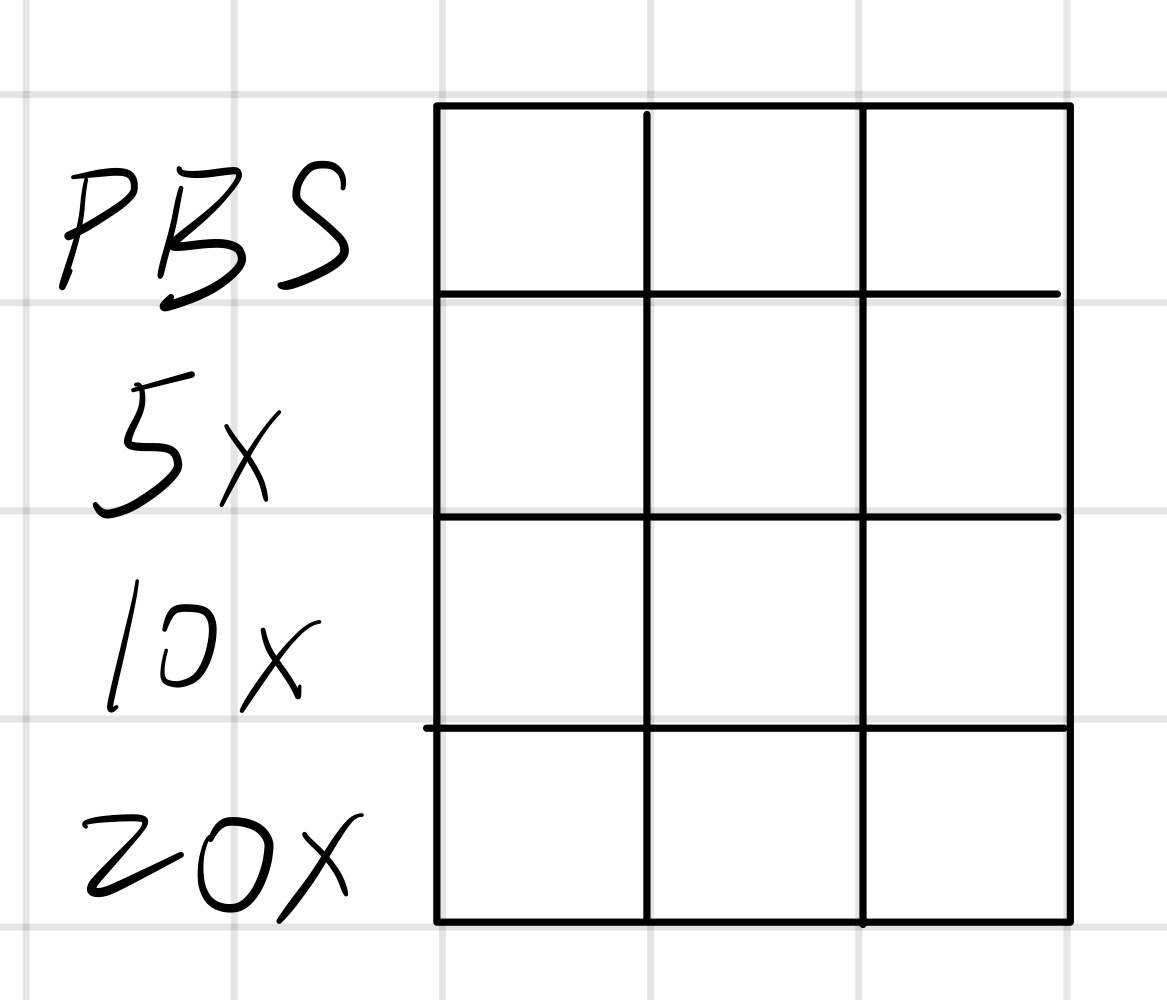
稀释菌液
- 取3个样品管,按照下表先加入相应量的PBS,再加母液,并用移液枪抽打。
- 800μL PBS,200μL母液
- 900μL PBS,100μL母液
- 950μL PBS,50μL母液
酶标仪测试吸光度计算稀释倍数
- 200μL PBS作空白对照,点板
- 平行测试3次取平均值与空白差值,即为OD值。(一般以107 cells/mL为标准浓度,大肠杆菌、金黄色葡萄球菌与之对应的OD值分别是0.01和0.1)
- 拟合估算母液OD值,例如测得大肠杆菌OD值数0.76,则需稀释76倍得到标准浓度菌液
培养皿制作
LB培养基
肉汤培养基
涂板操作
- 涂布棒消毒:将涂布棒浸泡在酒精中消毒,取出后放在酒精灯上烘干,重复消毒3次
- 稀释菌液:将与材料作用后的细菌使用PBS配置成初始菌液,将其稀释一定倍数(具体稀释倍数根据个人实际情况计算)
- 涂板:将平板放置在自动转盘中央,滴加一定体积的菌液(一般是50μL),启动自动转盘,同时将涂布棒向逆时针方向转圈,当感受到涂布棒稍有阻力时,停止涂板,将板倒扣,随后放入烘箱,培养一定时间(具体培养时间根据菌种确定)
注意:
- 理想效果的涂板效果为:培养后,培养板上的密度不超过500 cells/板,但实际上考虑细菌活性,可设为1000 cells/板。(个人计算菌液稀释倍数和涂布细菌体积时需考虑)
- 涂布的时候涂布棒要往一个方向旋转,不能每个方向都涂;涂布棒在涂布过程中不能碰到培养皿的壁
- 使用涂布棒前需确认其已冷却;每次使用完涂布棒,应浸泡在酒精中重新进行消毒,避免带来实验误差